Разрушение молекул фосфора P4 ультрафиолетовым светом может стать безопасным и простым способом получения многих промышленных и бытовых химикатов.
Фосфор - минеральный элемент, является важнейшим компонентом удобрений, пестицидов, моющих средств и других промышленных и бытовых химикатов. Его выделяют из горных пород, что является опасным и дорогостоящим, химики пытаются упростить этот процесс в течение десятилетий.
Профессор Массачусетского технологического института Кристофер Кумминс и один из его аспирантов, разработали новый способ получения фосфорорганических соединений расщеплением фосфора ультрафиолетовым светом. Их метод, устраняет необходимость в хлоре, который обычно требуется для таких реакций и представляет опасность для здоровья. Пока этот способ не подходит для промышленного применения, но он открывает дверь в новую область исследований, которые могли бы привести к применению в промышленных масштабах.
Получение фосфора
Большинство месторождений природного фосфора образованы отложениями ископаемых животных, которых особенно много на дне высохших морей. Эти осадочные породы называются фосфоритами. Они обычно содержат примеси, такие как кальций и др. металлы, которые должны быть удалены.
После очистки отложений получается белый фосфор, каждая молекула которого имеет тетраэдрическую структуру, напоминающую четырехугольную пирамиду, в которой каждый угловой атом связан с тремя другими. Известный как P4, белый фосфор является наиболее стабильной формой молекулярного фосфора. (Есть еще несколько полимерных форм, наиболее распространенными из которых являются черный и красный фосфор, которые состоят из длинных цепей.
В большинстве промышленных производств, только один атом фосфора должен быть присоединен к другой молекуле, поэтому необходимо разделить молекулу P4 на отдельные атомы. Это обычно делается в два этапа. Во-первых, три атома фосфора из четырех заменяют хлором, в результате чего получают PCl3 молекулу в которой атом фосфора связан с тремя атомами хлора. Затем эти атомы хлора, замещают органическими (углеродсодержащие) молекулами, получая разнообразные фосфорорганических соединений, такие как пестициды и др. Однако, эта процедура является дорогостоящей и опасной. Хлор использовался в качестве химического оружия во время Второй мировой войны, и как следствие химики пытаются найти новые способы получения фосфорорганических соединений без использования хлора.
Новая реакция
Профессор Кумминс давно занимается изучением фосфора, отчасти из-за своей необычной тетраэдрической структуры P4. Фосфор находится в той же группе периодической таблицы, что и азот, который наиболее стабильный в форме N2, поэтому химики предположили, что фосфор может формировать стабильную структуру P2. Однако это не так.
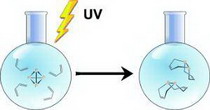
Несколько лет, научно-исследовательская группа Кумминса искала пути получения P2 из Р4 в надежде присоединить меньшие молекулы фосфора к органическим веществам. Во время исследования, Кумминс обратил внимание на статью, опубликованную в 1937 г., что в которой говорилось о том, что фосфор P4 может быть разделен на две молекулы P2 ультрафиолетовым светом. В том старом исследовании, P2 полимеризовался в красный фосфор.
Профессор решил выяснить, что произойдет, если P4 разделить УФ-излучением в присутствии органических молекул с ненасыщенными углеродными связями. После 12 часов воздействия УФ излучения, он обнаружил, вещество названное тетра-органо-дифосфан образовалось, и содержит два атома фосфора соединенные с двумя органическими молекулами.
Это предполагает, но окончательно не доказывает, что существует P2 форма, которая сразу соединяется с органическими молекулами. В будущих исследованиях, Кумминс надеется непосредственно получить молекулы P2, если они действительно существуют. Он также планирует выяснить, какие другие фосфорорганические соединения могут быть синтезированы в ультрафиолетовых лучах, в том числе и фосфор-металлорганические. Уже получены никель-содержащие молекулы фосфорорганических соединений, которые могут найти свое применение в электронике.