На присутствие меди укажет уже окраска. Если у сплава красный или желтый оттенок, вероятно, в нем имеется медь. Правда, например, сплавы меди с серебром даже при высоком содержании меди имеют серебристый цвет. Старые, так называемые серебряные монеты содержат от 10 до 75 % меди! Предварительную пробу проведем, капнув на металл азотной кислотой. На присутствие меди укажет появляющаяся чаще всего после высыхания зеленая кромка нитрата меди (похожую реакцию дает никель). Исследуем полученное соединение с помощью перла буры. Для этого нагреем палочку магнезии в несветящемся пламени и горячей погрузим ее в буру.
Прилипнувшая соль сплавится, в результате получится стекловидный шарик. Этот шарик в горячем состоянии положим на след соединения меди, например, на кромку нитрата, образовавшегося в предыдущем опыте. После нагревания в окислительном пламени перл буры окрасится в зеленый цвет, который при охлаждении изменится на голубой. Соединение никеля в этом случае окрасит буру в коричневый цвет.
Наконец, растворим немного металла в азотной кислоте. Как при всех аналитических реакциях, будем применять как можно меньшее количество вещества. Вполне достаточно будет кусочка, величиной с булавочную головку.
Зальем в пробирке металл азотной кислотой. Он растворится с образованием ядовитых красно-коричневых паров оксида азота. Поэтому будем проводить опыт обязательно на открытом воздухе или под тягой.
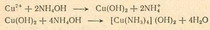
Если раствор окрасится в голубовато-зеленый цвет, то, вероятно, в сплаве присутствует медь. Чтобы убедиться в этом наверняка, разбавим раствор дистиллированной водой и разделим его. К первой порции добавим по каплям гидроксид аммония (нашатырный спирт). Если в сплаве присутствует медь, то сначала выпадет в осадок гидроксид меди Сu(ОН)2, который при добавлении избытка гидроксида аммония растворится, окрасив раствор в темно-синий цвет. При быстром добавлении нашатырного спирта осадок не выпадает, а сразу наблюдается синяя окраска:
В результате этой реакции образуется гидроксидтетраммин меди (II). Это пример комплексного соединения. Для того чтобы понять его строение, представим себе, что четыре группы NН3 располагаются вокруг иона меди и образуют вместе с ним один большой катион, который в свою очередь связан с ионами гидроксила.
Такие комплексы могут быть очень устойчивы. Если в растворе присутствует медь, то она не даст осадка при взаимодействии с NaOH, но при добавлении сероводородной воды выпадет в осадок черно-коричневый сульфид меди.
Ко второй порции растворенной металлической пробы добавим немного раствора желтой кровяной соли (гексациано-(П)феррат калия). (Осторожно! Яд!) Если выпадет красно-коричневый осадок, то наличие меди будет доказано.
Прежде чем проводить все аналитические реакции обнаружения, следует поставить вопрос, достаточно ли они отчетливы.
Например, если в растворе содержится ион никеля, то при добавлении аммиака будет наблюдаться такая же окраска раствора, которая образуется при наличии меди, а в присутствии железа, напротив, обе пробы могут быть неотчетливо выражены. Поэтому для точного определения меди необходим совпадающий результат всех предварительных проб и реакций. Если же в растворе имеются ионы железа, то иногда металлы следует химически разделить.
Укажем также на то, что соли меди ядовиты (как большинство солей тяжелых металлов). Раствор сульфата меди, например, действует как рвотное средство.