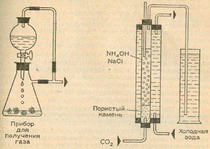
Для этого опыта применим аппарат, в котором при небольшом давлении получим диоксид углерода (углекислый газ). Подсоединим к газоотводной трубке этого аппарата Т-образную трубку, одно колено которой свяжем с капельной воронкой. Диоксид углерода получим при взаимодействии кусочков мрамора и 20 %-ного раствора соляной кислоты. Чтобы проконтролировать количество образующегося газа, подсоединим к газообразователю промывную склянку, частично наполненную водой. Диоксид углерода должен проходить через реакционный сосуд в виде мелких пузырьков.
Для этой цели приобретем в зоологическом магазине не слишком большой пористый камень, который применяется в аэрационнон установке аквариума. Напильником придадим ему круглую форму, чтобы он подошел к стеклянной трубке, имеющей внутренний диаметр 15—20 мм (трубка для сжигания длиной примерно 30 см). Трубку, подводящую газ, приклеим к камню водостойким клеем. Диаметр ее должен быть не менее 6 мм. Перед сборкой аппаратуры проверим проницаемость камня, погружая его в воду и пропуская через него воздух. Реакционный сосуд укрепим на штативе. Избыток диоксида углерода улетучится в воздух через открытую вверху трубку. Если имеется подходящее оборудование, можно сделать вокруг реакционного сосуда охлаждающую рубашку (так как температура при реакции не должна превышать 30 °С), а реакционный сосуд закрыть сверху пробкой с двумя отверстиями, в одном из которых помещается термометр, а в другом — отводная трубка. Но можно использовать и более простую установку.
Применяя трубку длиной 30 см и диаметром 2 см, мы используем 60 мл реакционного раствора. Его мы можем приготовить двумя путями: или смешав 20 мл концентрированного раствора гидроксида аммония с 40 мл насыщенного раствора поваренной соли (14 г NaCl в 40 мл Н2O), или растворив до насыщения поваренную соль в концентрированном растворе гидроксида аммония.
Примерно через 20 мин после начала опыта раствор помутнеет — это началось выделение гидрокарбоната натрия.
Теперь необходимо внимательно следить за реакцией в трубе, так как выпадающая соль может закрыть поры в камне. Из-за этого в промывной склянке и газообразователе повысится давление газа. Надо тотчас же отсоединить реакционную трубу и промывную склянку и зажать шланг. Затем приостановим образование диоксида углерода.
Оставим еще на некоторое время раствор в трубе для охлаждения; выделение гидрокарбоната натрия при этом продолжится. Наконец, отфильтруем и просушим соль, отжав ее между листами фильтровальной бумаги и оставив в умеренно теплом месте. Мы получим более 5 г гидрокарбоната натрия, который необходимо еще кальцинировать. Поместим его в пробирку из термостойкого стекла, закроем ее пробкой со вставленной газоотводной трубкой и укрепим на штативе. Сначала сильно нагреем гидрокарбонат натрия на пламени горелки. Выделяющийся газ соберем в пневматической ванне. Докажем с помощью горящей лучины и взаимодействием с известковой водой, что это диоксид углерода. В пробирке останется карбонат натрия, при взаимодействии которого с разбавленной соляной кислотой выделяется диоксид углерода:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
По способу Сольве аммиак регенерируют, смешивая раствор хлорида аммония с известковым молоком. Добавим в пробирку с несколькими миллилитрами раствора хлорида аммония немного гашеной извести Са(ОН)2, выделяющийся аммиак обнаружим известным способом:
2NН4Сl + Са(ОН)2 → СаСl2 + 2Н2О + 2NH3↑
Безводная, или кальцинированная, сода — гигроскопичный белый порошок, который очень хорошо растворяется в чуть теплой воде.
Раствор соды дает щелочную реакцию. Сода получается в кристаллическом виде, если ее осаждать из раствора при температуре ниже 32 °С. Кристаллическая сода имеет формулу Na2CO3*10H2O. Это значит, что при кристаллизации на 1 моль карбоната натрия всегда приходится 10 молей кристаллизационной воды. При длительном хранении прозрачные кристаллы покрываются белым налетом.
Благодаря «выветриванию» они теряют воду, и на поверхности остается безводный карбонат натрия.
Сейчас Германия по производству соды на душу населения занимает ведущее место в мире. На предприятиях по производству соды в Бернбурге и Штасфурте ежедневно производится более 1000 т соды, которая большей частью экспортируется.
Особенную проблему представляют собой сотни тысяч кубических метров отходов, ликвидация которых требует больших затрат. В последние годы эти отходы частично используются в качестве наполнителя в смеси с цементом и кварцевым песком для изготовления газобетона.