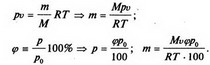
После того, как было установлено экспериментально, что 1 моль любого газа при нормальных условиях (Р = 1 атм = 1,013.105 Па; t =0 °С или Т= 273 К) занимает объем 22,4 л, объединенный газовый закон для одного моля любого газа стали записывать так:
Р V = R Т, (1)
где R - универсальная газовая постоянная.
Действительно, объединенный газовый закон для любой постоянной массы газа (а значит, и для одного моля газа) имеет вид:
P 1 V 1 / T 1 = P 2 V 2 / T 2 ,
или
PV / T = const ,
но и для одного моля газа const имеет одно и то же значение для всех реальных газов при таких условиях, при которых они ведут себя как идеальный газ. Обозначив эту постоянную R , получим уравнение (1).
Газовая постоянная равна работе расширения 1 моля идеального газа при нагревании на 1 К при постоянном давлении.
Чтобы найти численное значение R , необходимо знать, какой объем занимает газ при каких-либо определенных значениях Р и Т. Проще всего считать условия нормальными, тогда
R = PV / T = P 0 V 0 / T 0
и в системе СИ R = 8,3144 Дж/(моль • К).
Левая часть уравнения (1) увеличивается в v раз, так как v молей займут в v раз больший объем, а правая часть не изменится ( R - постоянная величина, а T не зависит от числа молей). Чтобы уравнение (1) было справедливо для v молей, надо умножить правую часть на v :
PV = vRT , (2)
где v = m / M ; число молей равно общей массе газа, деленной на молярную массу. Подставляя это значение в уравнение (2), получим
PV = m / M . RT (3)
Уравнение идеального газа в форме (2) и (3) называется уравнением Клапейрона-Менделеева, оно выражает взаимосвязь между всеми величинами, характеризующими газ, а поэтому является наиболее общим в приближении модели идеального газа.
Из уравнения Клапейрона-Менделеева можно вывести ряд простых, но важных следствий.
1) Многие газовые реакции происходят при постоянных температуре и давлении. При этих условиях
V = (R Т / Р ) • v = const•v. (4)
Уравнение (4) есть не что иное как закон Авогадро, который утверждает, что в равных объемах газов при постоянных температуре и давлении содержится одинаковое число молекул.
2) Другое интересное следствие касается плотности газов. Из уравнения (3) следует, что
ρ = т/ V = (Р/ R Т) • М = const • М (5)
при постоянных давлении и температуре. Это означает, что при этих условиях плотность газа определяется только его молярной массой. Такой результат позволяет ввести понятие относительной плотности одного газа по другому:
D 1 = ρ 1 / ρ 2 = M 1 / M 2 (6)
Эта величина показывает, во сколько раз первый газ тяжелее второго при одинаковых условиях.
3) Если реакция происходит в замкнутом сосуде ( V = const ) при постоянной температуре, то
P = ( RT / V ) • v = const • v . (7)
Это соотношение означает, что в замкнутом сосуде при заданных условиях давление зависит только от общего числа молекул газов.