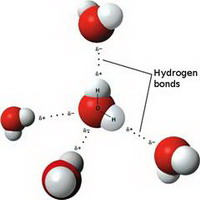
Водородная связь - это своеобразная химическая связь. Она может быть межмолекулярной и внутримолекулярной.
Межмолекулярная водородная связь возникает между молекулами, в состав которых входят водород и сильно электроотрицательный злемент - фтор, кислород, азот, реже хлор, сера. Поскольку в такой молекуле общая электронная пара сильно смещена от водорода к атому электроотрицательного элемента, а положительный заряд водорода сконцентрирован в малом объеме, то протон взаимодействует с неподеленной электронной парой другого атома или иона, обобществляя ее. В результате образуется вторая, более слабая связь, получившая название водородной.
Обычно водородную связь обозначают точками и этим указывают, что она намного слабее ковалентной связи (примерно в 15-20 раз). Тем не менее она ответственна за ассоциацию молекул. Например, образование димеров (в жидком состоянии они наиболее устойчивы) воды и уксусной кислоты можно представить схемами:
Как видно из этих примеров, посредством водородной связи объединены две молекулы воды, а в случае уксусной кислоты - две молекулы кислоты с образованием циклической структуры.
Водородная связь оказывает влияние на свойства многих веществ. Так, благодаря водородной связи фтороводород в обычных условиях существует в жидком состоянии (ниже 19,5оС) и содержит молекулы состава от Н2F2 до Н6F6. Благодаря водородной связи образуется
гидродифторид-ион :
который входит в состав солей - гидрофторидов (КНF2 - гидродифторид калия, NH4HF2 - гидродифторид аммония).
Наличием водородных связей объясняется более высокая температура кипения воды (100оС) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те). В случае воды надо затратить дополнительную энергию на разрушение водородных связей.
Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, а потому эти связи играют важную роль в химии процессов жизнедеятельности.