Ученые из Кембриджского университета работают над увеличением эффективности процесса синтеза аммиака. 3-5% природного газа в мире используется для создания искусственных удобрений, новое исследование может иметь серьезные последствия для сельскохозяйственного и энергетического секторов.
Аммиак (NH3) - является одним из наиболее важных химических веществ в современном мире, в основном, благодаря его использованию в производстве искусственных удобрений, которых производится более 100 млн. тонн в год, и которые обеспечивают продовольствием одну треть жителей Земли.
В природе, аммиак производится растениями (преимущественно бобовыми) и некоторыми бактериями, которые извлекают азот из атмосферы в процессе, известном как фиксация азота. Она происходит при комнатной температуре и нормальном давлении, но искусственная фиксация азота (по Габеру-Бошу) для производства огромных количеств аммиака, необходимого для удовлетворения глобальных запросов, требует высоких давлений (150-250 атмосфер) и высоких температур (300-550 градусов Цельсия). Как говорилось ранее, около 3-5% добычи природного газа в мире, потребляются в цикле Габера-Боша, что составляет около 1-2% от антропогенных поставок энергии в мире.
Стив Дженкинс, доктор химического факультета Кембриджского университета и один из соавторов работы, утверждает, что цикл Хабера-Боша был разработан в начале двадцатого века, и мало изменился с тех пор, очевидно, учитывая массовый масштаб мирового производства аммиака, что даже крошечные улучшения эффективности процесса его синтеза, могут иметь огромные последствия не только для экономики производства удобрений, но и для глобального спроса на энергию.
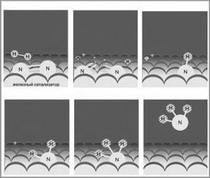
Одним из ключевых соединений, позволяющих проводить такой цикл, является железный катализатор, который стимулирует диссоциацию молекул N2, а также предоставляет платформу, на которой атомы азота последовательно гидрогенизируются с образованием NH, NH2 и, наконец, NH3. В течении десятилетий тратилось много сил для улучшения нашего понимания того, каким образом железный катализатор работает, почему добавление таких элементов как калий, улучшает его свойства, и поиск закономерностей, которые могли бы нам подсказать лучший и более эффективный катализатор.
Говорит д-р Дженкинс: Раньше, для изучения такого катализа, требовался образец монокристаллического железа высокой чистоты, и как правило, эксперименты проходили в ультра высоком вакууме (УВВ), т.е. в условиях, где давление составляет менее одной миллионной миллионной атмосферы. Мы смогли использовать некоторые из привлекательных особенностей тех испытаний в своих экспериментах, но при большем давлении .
Вначале, для создания на поверхности железного катализатора слоя из атомов азота (до плотности чуть более одного атома азота на два атома железа поверхностного слоя), ученые подвергли железный образец воздействию ионов азота. В (УВВ) условиях, возможно использовать оже-электронную спектроскопию (ОЭС) для определения количества азота на поверхности катализатора. Затем, ученые обрабатывали образец газообразным водородом (H2) при давлении до 0,6 мбар в течении нескольких минут. Это очень низкое давление по сравнению с промышленными условиями, но его достаточно для довольно быстрого протекания реакции.
Недостатком использования давления отличного от ультра высокого вакуума является то, что в таких условиях не возможно использовать оже-электронную спектроскопию во время реакции, но эту проблему можно обойти работая эпизодически. После экспозиции в несколько минут, они эвакуируют экспериментальную камеру и быстро возвращаются к глубокому вакууму оценивая количество азота на поверхности с помощью ОЭС, затем реакцию с H2 повторяют. Проделав такие изменения несколько раз, ученые могут изучить зависимость падения концентрации азота на поверхности катализатора, от времени и температуры. Такая гидрогенизация проходит с количеством азота, предварительно нанесенного на не большую поверхность, при этом ученые понимают, что они никогда не произведут достаточного количества аммиака, чем количество способное охватить небольшую часть поверхности катализатора при температуре и давлении реакции, участвующие в работе, но при этом, они знают, что эксперимент моделирует одну из ступенек промышленного цикла, которая определяет общую скорость процесса.
Профессор химического факультета Кембриджского университета сэр Дэвид Кинг, говорит: Интересно, что благодаря данным полученным в экспериментах мы обнаружили, что реакция ускоряется на 20%, если добавить немного калия на поверхность. Такой же результат наблюдается и в цикле Габера-Боша в условиях минимального производства аммиака, когда определяющей стадией является диссоциация N2. Но результаты также позволяют предположить, что в определенных условиях, а именно, когда давление аммиака поддерживается на низком уровне, стадия гидрирования (от N к NH к NH2 к NH3) может, на самом деле, быть самой важной. Стоит сказать о еще одном важном аспекте текущей работы, который состоит в том, что работа с железом заключает в себе большие трудности по сравнению с другими металлами, используемыми в катализе, такими как платина, медь, никель. Железо чрезвычайно склонно к высоким содержаниям примесей, которые могут мешать протеканию реакции уменьшая катализирующие свойства металла.
Ранее были необходимы месяцы усилий для очистки образца, с помощью водорода, распыления ионов аргона, отжига, и очистки кислородом. Кроме того, предыдущая работа с железным монокристаллом в условиях ультравысокого вакуума (работа Герхарда Эртлья) требовало насыщать приповерхностную область материала азотом, для предотвращения диффузии азота в объем. Работая с более высоким давлением водорода, мы можем оперировать более низкими температурами, препятствуя появлению многих проблем ,- говорят исследователи.