Химики из США создали молекулярную вазу, работающую по аналогии с активным центром фермента.
Химические катализаторы небелковой природы отличаются лишь хемоселективностью – они способны распознавать и трансформировать строго определенную функциональную группу, однако практически не могут различать молекулы различной формы с одинаковым набором функциональных групп. Такое возможность присуща лишь катализаторам-ферментам. Обычно ферменты отличаются высокой специфичностью в каталитических процессах: форма субстрата и его взаимодействие с активным центром фермента являются важными факторами обеспечения этой специфичности.
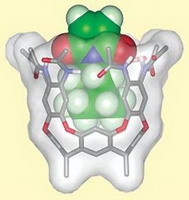
Джулиус Ребек Младший (Julius Rebek Jr.) и Ричард Хули (Richard Hooley) из Исследовательского Института Скриппса (Калифорния) поставили пред собой цель создания химической системы, сочетающей черты специфической каталитической активности ферментов наряду с сохранением свойств «нормального» химического катализатора. Исследователи синтезировали молекулу в форме вазы (кавитанд) и использовали ее для катализа реакции Дильса-Альдера ненасыщенного имида и ароматического спирта.
Система Ребека подражает работе фермента в том, что кавитанд обладает полостью, способной вместить лишь субстрат подходящего размера и формы. Функциональные группы, обеспечивающие водородное связывание по верхнему ободу кавитанда, активируют субстрат (ненасыщенный имид), оттягивая электронную плотность с кратных связей. Это обстоятельство увеличивает реакционную способность субстрата и увеличивает скорость участия его в реакции Дильса-Альдера с ароматическим спиртом. Размеры продукта не позволяют ему разместиться в полости, полость освобождается и может активировать очередную молекулу субстрата.