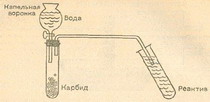
Для разложения воды электрическим током чаще всего используют аппарат Гофмана. Кто не располагает таким аппаратом, может сам легко построить подобное приспособление. Возьмем кусок очень широкой стеклянной трубки (например, химический стакан или широкогорлую склянку без дна. Как удалить дно, описано в главе 8, а острые края надо оплавить на пламени бунзеновской горелки). Отверстие трубки или горло склянки закроем очень плотно подогнанной резиновой пробкой. В пробке на не слишком близком расстоянии друг от друга просверлим два отверстия, в которые в качестве электродов вставим два угольных стержня. Такие стержни можно купить или взять из батарейки для электрического карманного фонаря. Перед применением очистим угольные стержни длительным кипячением в воде. К нижним концам угольных стержней присоединим токоподводы из изолированной медной проволоки. Лучше всего достать у электрика подходящие клеммы и к ним припаять зачищенные концы проводов. В крайнем случае обмотаем стержень проволокой. Изоляционный лак с проволоки необходимо тщательно счистить, а число витков должно быть достаточно большим. Провода подсоединить к батарейке для карманного фонарика или, лучше, к свинцовому аккумулятору. Если найдется переменное сопротивление в несколько ом, включим его в цепь. Тогда скорость электролиза будет хорошо регулироваться.
Наполним изготовленный электролизный сосуд примерно на две трети водой, в которую добавим немного разбавленной серной кислоты. Чистая вода проводит электрический ток очень плохо. Уже незначительное количество кислоты сильно повышает проводимость. Лучше всего, чтобы концентрация серной кислоты составляла 2—4 %. Осторожно — даже разбавленная серная кислота разъедает кожу. Запомните навсегда: при разведении кислоты ее следует очень медленно вливать в воду; ни в коем случае нельзя поступать наоборот — вливать воду в кислоту.
Ячейка готова. Теперь замкнем электрическую цепь. На обоих электродах выделяется газ: на положительном полюсе (аноде) слабее, на отрицательном (катоде) — сильнее. Соберем газы для их изучения. Для этого поместим перевернутые наполненные водой пробирки над электродами — только, чтобы они не стояли на резиновой пробке, а то электрическая цепь прервется.
В обеих пробирках соберется газ. В идеальном случае нужно ожидать, что на аноде образуется ровно вдвое меньше газа, чем на катоде. Ведь на аноде выделяется кислород, а на катоде — водород. Так как формула воды Н2О, то на один атом кислорода приходится два атома водорода, и при разложении воды должно образовываться в два раза больше атомов водорода, чем кислорода. С другой стороны, мы знаем из школьного курса, что в равных объемах газов всегда содержится равное число молекул (закон Авогадро), а как молекула водорода, так и молекула кислорода содержат два атома элемента.
Несмотря на правильность этой теории, мы будем несколько разочарованы, когда сравним полученные объемы газов. Кислорода будет мало, так как часть его соединится с углеродом электрода. Для точных исследований необходимо применять электроды из благородного металла (лучше всего платины).