Все химические реакции можно разделить на два типа. К первому из них относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ.
Например:
=
=
Как видно, степень окисления каждого из атомов до и после реакции осталась без изменения.
Ко второму типу относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ.
Например:
=
=
Здесь в первой реакции атомы хлора и кислорода, а во второй - атомы брома и хлора изменяют степень окисления.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Изменение степени окисления связано с оттягиванием или перемещением электронов.
Окислительно-восстановительные реакции - самые распространенные и играют большую роль в природе и технике.
Рассмотрим основные положения теории окислительно-восстановительных реакций.
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
Например:
Al – 3e - = Al3+ Fe2+ - e- = Fe3+
H2 – 2e- = 2H+ 2Cl - - 2e- = Cl2
При окислении степень окисления повышается.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
Например:
S + 2е - = S2- Сl2 + 2е - = 2Сl- Fe3+ + e - = Fe2+
При восстановлении степень окисления понижается.
3. Атомы, молекулы или ионы, отдающие электроны называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются. Так как атомы, молекулы и ионы входят в состав определенных веществ, то и эти вещества соответственно называются восстановителями или окислителями.
4. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями:
Восстановитель – е - Окислитель
Окислитель + е - Восстановитель
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
При этом, независимо от того, переходят ли электроны с одного атома на другой полностью или же лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединении электронов.
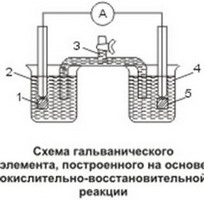
Процессы окисления и восстановления можно физически отделить друг от друга и осуществить перенос электронов по внешней электрической цепи. Пусть в стакан 2 налит раствор иодида калия КI , а в стакан 4 - раствор хлорида железа (III) FeСl3. Растворы соединены между собой так называемым «электролитическим ключом» 3 – U-образной трубкой, заполненной раствором хлорида калия КCl, обеспечивающим ионную проводимость. В растворы опущены платиновые электроды 1 и 5. Если замкнуть цепь, включив в нее чувствительный амперметр, то по отклонению стрелки можно будет наблюдать прохождение электрического тока и его направление. Электроны перемещаются от электрода с раствором иодида калия к электроду с раствором хлорида железа (III), т.е. от восстановителя - ионов I - - к окислителю – ионам Fe3+. При этом ионы I- окисляются до молекул иода I2, а ионы Fе3+ восстанавливаются до ионов железа (II) Fe2+. Через некоторое время продукты реакций можно обнаружить характерными реакциями: иод - раствором крахмала, а ионы Fe2+ - раствором гексациано-(II) феррата калия (красной кровяной соли) К3[Fе(СN)6].
Приведенная на рисунке схема представляет собой гальванический элемент, построенный на основе окислительно-восстановительной реакции. Он состоит из двух полуэлементов: в первом протекает процесс окисления восстановителя:
2I - - 2e - = I2
а во втором - процесс восстановления окислителя:
Fe3+ + е - = Fe2+
Поскольку эти процессы протекают одновременно, то, умножив последнее уравнение на коэффициент 2 (для уравнивания числа отданных и присоединенных электронов) и суммируя почленно приведенные уравнения, получим уравнение реакции:
2I - + 2Fe3+ = I2 + 2Fe2+
или
2KI + 2FeCl3 = I2 + 2FeCl2 + 2KCl
Всякая окислительно-восстановительная реакция может служить источником электрического тока, если она протекает в гальваническом элементе.
Важнейшие восстановители и окислители
|
Восстановители |
Окислители |
|
Металлы, водород, уголь Оксид углерода (II) CO Сероводород H2S, оксид серы (IV) SO2, сернистая кислота H2SO3 и ее соли Иодоводородная кислота HI, бромоводородная кислота HBr, соляная кислота HCl Хлорид олова (II) SnCl2, сульфат железа (II) FeSO4, сульфат марганца (II) MnSO4, сульфат хрома (III) Cr2(SO4)3 Азотистая кислота HNO2, аммиак NH3, гидразин N2H4, оксид азота (II) NO Фосфористая кислота H3PO3 Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза Катод при электролизе |
Галогены Перманганат калия KMnO4, манганат калия K2MnO4, оксид марганца (IV) MnO2 Дихромат калия K2Cr2O7, хромат калия K2CrO4 Азотная кислота HNO3 Кислород O2, озон О3, пероксид водорода Н2О2 Серная кислота H2SO4 (конц.), селеновая кислота H2SeO4 Оксид меди (II) CuO, оксид серебра (I) Ag2O, оксид свинца (IV) PbO2 Ионы благородных металлов (Ag+, Au3+ и др.) Хлорид железа (III) FeCl3 Гипохлориты, хлораты и перхлораты Царская водка, смесь концентрированной азотной и плавиковой кислот Анод при электролизе |